Flow cytometry를 이용한 실험의 예
Flow cytometry를 이용한 대표적인 활용 예들을 소개해보도록 하겠습니다.
1) 형광 항체를 활용한 실험
Flow cytometry의 목적은 세포가 발현하는 여러 가지 단백질들을 분석하여서 해당 세포가 어떤 세포인지 알아내며 분석하는 것입니다. 그래서 여러 가지 단백질(항원)에 특이적으로 결합할 수 있는 형광 항체들이 많이 개발되어있으며 이런 형광항체들을 활용하여서 세포들이 어떤 단백질을 발현하고 있는지 분석할 수 있습니다. 즉, 다양한 단백질 발현 프로필로 면역세포의 종류를 구분할 수 있는 방법입니다 (그림 4).
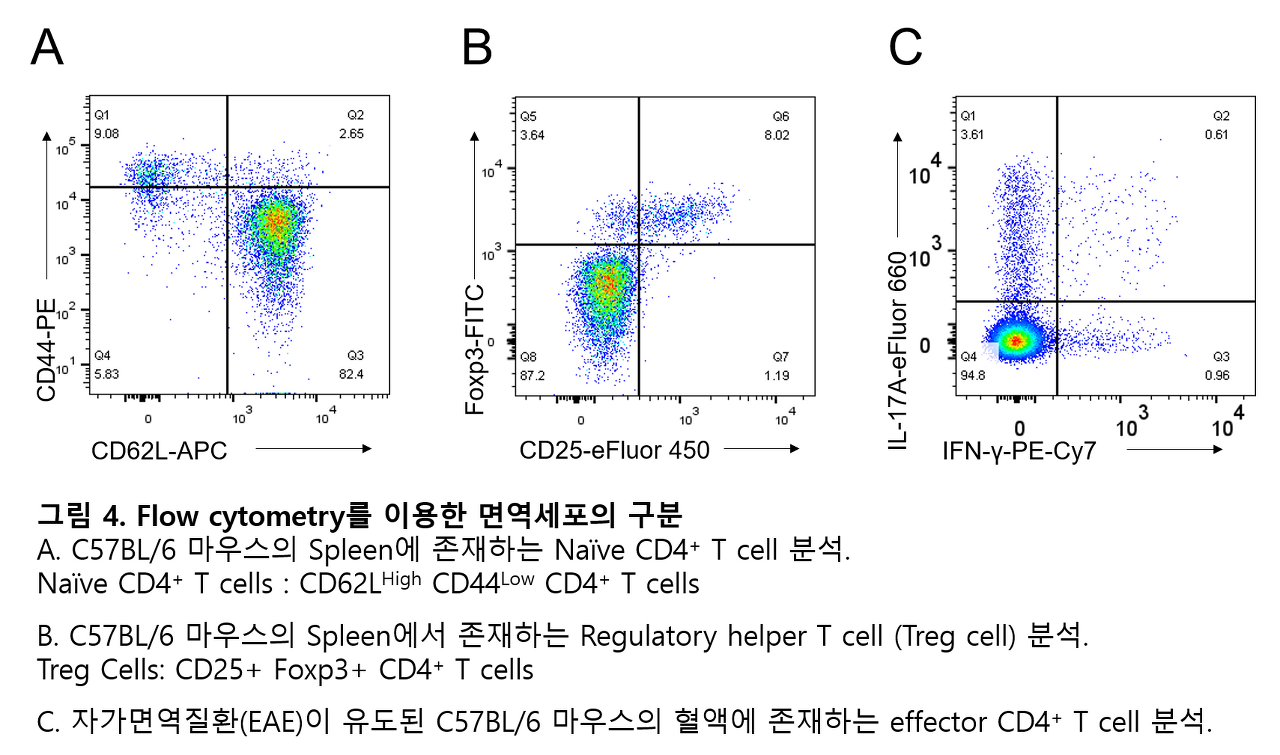
세포 내부에 존재하는 전사 조절인자 (그림. 4B) 및 cytokine (그림. 4C) 도 형광항체로 염색하여 측정할 수 있습니다. cytokine 같은 경우 세포가 분비해내는 단백질이지만, 단백질 수송 억제제 (Protein transport inhibitor)를 사용해 세포 내부에(Golgi 및 ER) cytokine이 축적되도록 하여 측정할 수 있습니다.
형광항체를 사용하는 것은 단백질의 유무 확인뿐만 아니라 인산기가 붙은 단백질(Phosphorylated protein)의 양을 확인하는 것도 가능합니다. 예를 들어 CD4+ T cell이 활성화되면 MAPK signal이 활성화되면서 ERK 단백질이 인산화됩니다. Fluorochrome-conjugated anti-phospho-ERK antibody를 활용하면 CD4+ T cell의 세포 수준에서 인산화된 ERK의 양을 측정할 수 있습니다 (그림. 5). 물론 Flow cytometry를 목적으로 개발된 형광항체의 종류가 Western blot을 목적으로 개발된 항체의 종류보다는 적기 때문에 인산화 정도를 Flow cytometry로 분석하는 데는 여전히 어느 정도 한계가 있지만, 세포 수준에서 분석한다는 부분에서 큰 장점이 있습니다. Flow cytometry를 위한 형광항체는 eBioscience, BD Bioscience, Biolegend 등등의 회사에서 개발되고 있으며, 원리는 비슷하지만 모든 형광항체가 Flow cytometry와 Confocal microscopy 간에 호환이 가능한 것은 아닙니다. 어떤 형광항체는 Flow cytometry에서는 사용 가능하지만, 신호가 약하거나 불안정해서 형광현미경에는 적합하지 않을 수 있습니다.
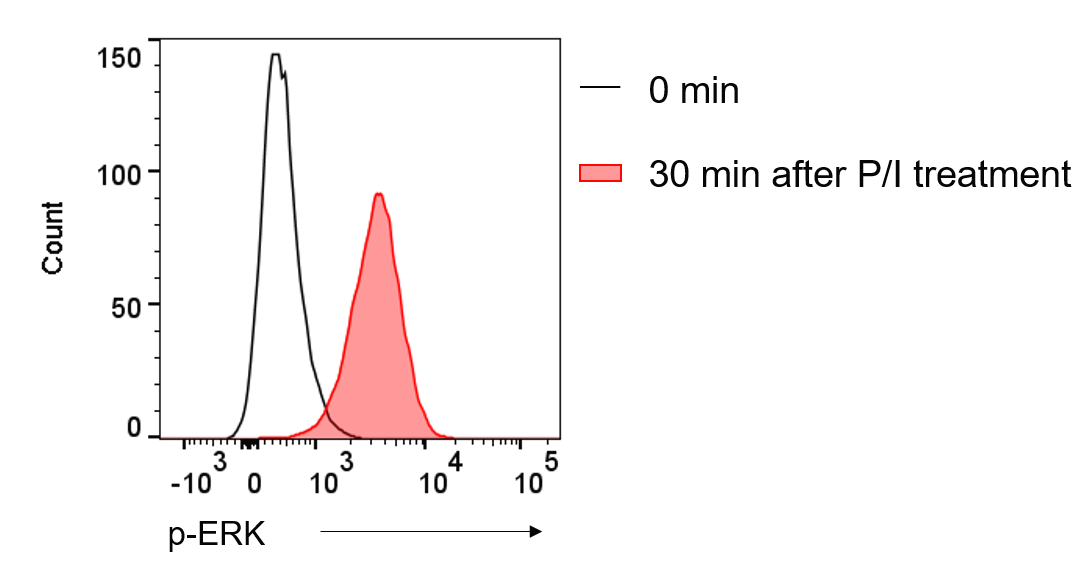
(그림5. PMA/lonomycin 처리 30분 뒤 측정한 CD4+ T cell 내부의 p-ERK 증가)
2) 형광단백질 분석
GFP(Green fluorescence protein)는 대표적인 형광 단백질입니다. 유전자 조작을 통해 세포 내에 이와 같은 형광 단백질이 발현되도록 한 마우스들이 많이 있는데, 세포 내에 발현되는 형광 단백질도 Flow cytometry를 통해 측정이 가능합니다. 이러한 형광 단백질과 Flow cytometry를 활용하면 특정 면역세포가 이전에 어떤 세포였는지를 확인함으로써 세포의 가소성(Plasticity)를 연구하는 것이 가능합니다. 예를 들어 Il17aCre Rosa26YFP 마우스의 경우 IL-17A라는 싸이토카인을 발현했던 경험이 있는 세포에서 지속적으로 YFP가 발현됩니다. 주목해야 하는 것은 일단 IL-17A가 한 번이라도 발현되면 지속적으로 YFP가 발현되기 때문에 현재 IL-17A 발현여부와 상관없이 IL-17A 발현 경험이 있는 세포는 YFP로 표지 된다는 것입니다. 이러한 마우스의 개발 및 Flow cytometry의 활용은 강직성척추염(Multiple sclerosis)의 동물모델인 EAE에서 IFN-γ를 발현하는 CD4+ T cell의 대부분이 IL-17A를 발현하는(혹은 했던) Th17 cell로부터 유래하였음으로 증명함으로써 Th17 cell plasticity에 대한 이해를 넓히는 데 기여했습니다(Hirota et al., 2011) (그림. 6).
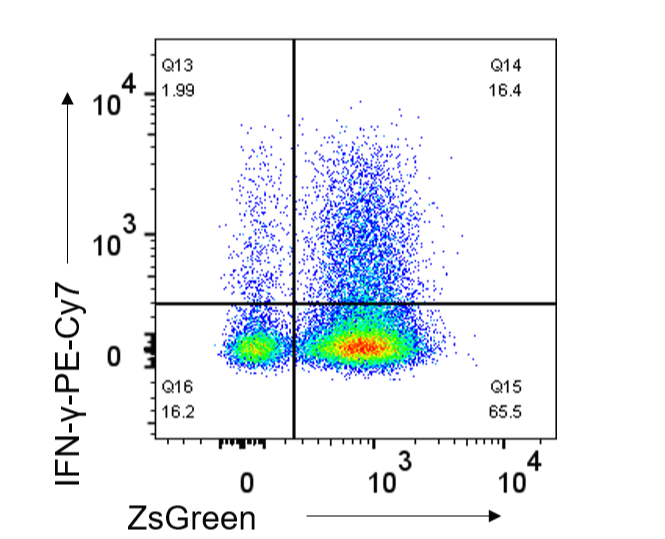
(그림6.실험에 사용된 마우스는 IL-17A를 발현했거나 발현하고있는 세포들에서 모두 형광단백질인 ZsGreen을 발현하게 된다. 해당 마우스에서 EAE를 유도한 뒤 spinal cord에 존재하는 CD4+ T cell을 분석한 결과, IFN-gamma-producing cells의 상당부분이 Th17 cell로부터 유래했음을 확인할 수 있다.
3) 형광 Dye를 활용한 실험: Cell proliferation
Flow cytometry의 기본이 형광을 측정하는 것이지만, 형광물질이 반드시 항체에만 붙어서 사용되는 것만은 아닙니다. 항체는 아니지만 널리 사용되는 것 중 하나가 CFSE입니다. CFSE는 세포막을 투과하여 세포 내부에 있는 단백질들에 비특이적으로 결합할 수 있는 꽤나 안정적인 형광물질입니다(Parish, 1999). 따라서 세포를 CFSE로 염색하면 염색된 모든 세포는 골고루 CSFE로 염색되고, CFSE는 계속해서 세포 내부에 남아있습니다. 그리고 세포가 분열할 때마다 세포질이 둘로 나뉘면서 각 세포가 보유하는 CFSE의 양도 절반으로 줄게 되고, 이는 결국 한 개의 세포가 낼 수 있는 형광이 절반으로 감소하는 결과를 낳습니다. 이렇게 세포가 n 번 분열함에 따라 이론적으로 CFSE의 형광도 1/2n로 감소하게 됩니다 (그림. 7). 이렇게 CFSE로 염색된 세포가 분열하고, 이를 Flow cytometry로 분석하면 CFSE 형광 수준에 따라 세포들이 구분되고, 각 그룹별 세포들을 비교함으로써 세포분열이 어느정도 일어났는지를 분석할 수 있습니다. 현재는 CFSE와 같은 원리이지만 다른 형광을 띠는 형광 Dye들이 다양하게 활용되고 있습니다.
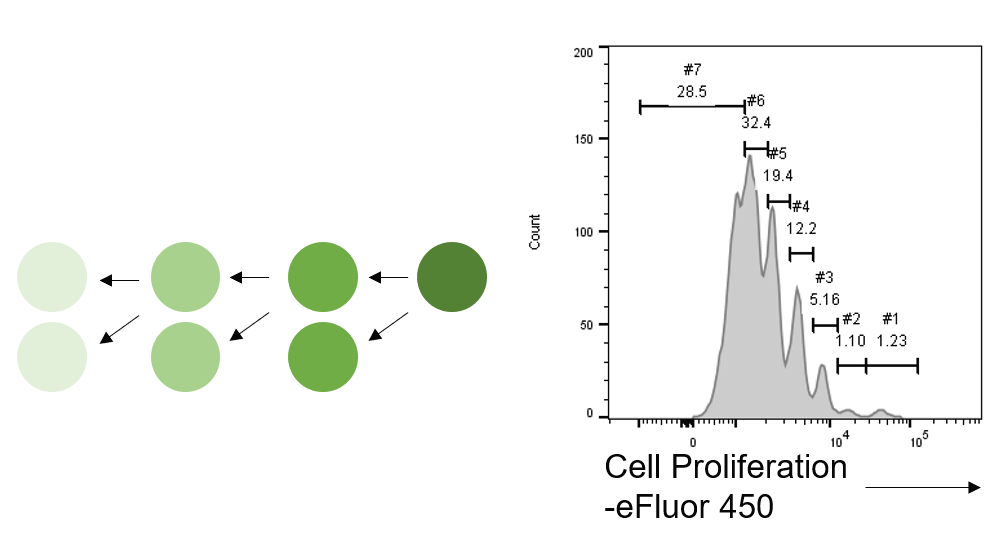
(그림7. CFSE로 염색된 세포는 분열을 반복함에 따라 CFSE의 양이 감소하고, 이는 CFSE의 형광이 감소하게되는 결과를 가져온다. 이렇게 CFSE 형광수준에 따라 세포들이 구분되고, 각 그룹별 세포들의 양을 비교함으로써 세포분역 정도를 분석할 수있다. )
4) RNA 측정: FISH의 응용
Flow cytometry를 활용해 RNA도 측정할 수 있습니다. 이는 FISH(Fluorescent in situ hybridization)를 응용한 기법입니다.
해당 기술의 핵심은 측정하고자 하는 RNA를 인식할 수 있는 Probe를 제작하여 RNA와 결합시키고, 해당 Probe가 만들어낼 수 있는 형광 신호를 증폭하는 데 있습니다. RNA를 인식하는 Probe를 형광으로 표지할 경우 하나의 Probe가 만들어낼 수 있는 형광의 세기가 너무나도 약하기 때문에 이 신호를 증폭하는 과정이 필요합니다. 따라서 Probe를 인식하는 DNA 서열들(Amplifier)을 추가적으로 덧붙여주고, 형광을 띠는 Labeling probe를 나중에 붙여줌으로써 형광 신호를 증폭시키는 것입니다 (그림. 8). 마치 1차 항체에 2차 항체를 붙여서 신호를 증폭시키는 것과 비슷한 원리입니다. 이러한 간단한 원리에도 불구하고 제품 가격이 상당히 비싸서 접근성이 조금 떨어지는 기술이지만, 세포 수준에서 단백질과 RNA 발현 정도를 비교할 수 있다는 점에서 획기적인 실험기법입니다.

(그림8 분석하고자 하는 RNA 서열을 인식하는 probe에 추가적인 preamplifier, amplifier, 형광을 띠는 lable probe를 연결하여 형광신호를 증폭시킴으로써 세포내 RNA를 flow cytometry로 분석할 수 있다. )
5) 세포 내 칼슘 농도 변화 측정
Flow cytometry를 사용해서 세포 내 금속이온의 농도 변화를 측정이 가능합니다. 대표적인 예시로 세포 내 칼슘 농도 변화를 측정하는 것이 있습니다.
면역 세포가 활성화되면 가장 빠르게 나타나는 현상 중 하나가 세포 내 칼슘이온의 증가입니다. 이렇게 증가한 칼슘이온에 결합하여 형광특성이 변하는 Fluo-4, Fluo-5, Indo-1 등등의 Calcium indicator들이 있고, 이러한 Calcium indicator들은 쉽게 세포 내부로 침투되는 성질들을 갖습니다. 따라서 Calcium indicator를 세포 내부로 투과시킨 후 세포에 적절한 반응을 주어 칼슘농도 변화를 유도하면, 칼슘과 결합한 Calcium indicator에 의한 형광을 실시간으로 측정할 수 있습니다 (그림. 9).

(그림9. Flu0-4로 염색된 CD4+ T cell에 Anti-CD3 antibody(hamster origin)와 Anti-Hamster IgG를 처리하여 CD4+ T cell을 활성화하면 세포내 칼슘 농도증가로 인해 Fluo-4에 의한 형광이 측정된다. )
이뿐만이 아닙니다. 칼슘이 결합하는 단백질인 Calmodulin과 M13 domain을 형광단백질에 융합하여 별도의 염색과정 없이 세포 내 칼슘 변화를 측정할 수도 있습니다 (GECI: Genetically encoded calcium indicators). 칼슘이 Calmodulin과 M13 domain에 결합함으로 인해 생기는 단백질 구조 변화가 형광단백질의 형광특성을 바꾸는 것이 그 원리입니다(Zhong and Schleifenbaum, 2019). 해당 단백질이 체내에서 발현되도록 만든 마우스에서를 이용하면 in vivo에서 일어나는 면역세포들의 활성을 실시간으로 측정할 수도 있습니다.
칼슘 이 외에도 나트륨, 아연 등의 금속이온 농도 변화, 세포 내 pH 변화, ROS 농도 변화 등을 인식할 수 있는 다양한 형광 Probe가 존재하며, Flow cytometry를 활용해 이러한 세포내 변화를 측정할 수 있습니다.
6) FACS (Fluorescence-activated cell sorting)
마지막으로 소개할 FACS라는 기법은 Flow cytometry를 활용한 기술의 최정점이라고 부르고 싶은 기술로서 Flow cytometry로 분석된 세포들 중에서 특정 세포만을 분류해내는 Sorting 기법입니다. 많은 사람들이 Flow cytometry와 FACS를 같은 의미로 말하곤 하는데, 사실 둘은 서로 다릅니다. Flow cytometry를 활용해 세포를 분류하는 기술이 FACS입니다. 일반적인 Flow cytometry 기계에 추가적으로 설치된 장치가 원하는 세포가 포함된 물방울에 양성 또는 음성 전하(Electronic charge)를 부여하고, 전하를 띠는 해당 물방울을 끌어당겨 해당 세포를 분류해내는 기술이 FACS입니다.
이렇게 분류해 낸 세포는 살아있는 세포들이기 때문에 추가적으로 Culture가 가능합니다. 또한 이렇게 얻은 세포들만을 가지고 Bulk RNA-seq 또는 Single cell RNA-seq 분석을 하는데 사용하기도 합니다. 장비가 매우 고가라서 보통은 Sorting을 전담으로 하는 Technician들이 있고, 연구자들은 Technician에게 부탁하여 원하는 세포만을 분류합니다.
flow cytometry의 기본 원리를 알고 싶으신 분은 아래 링크를 눌러주세요:)
2020/06/24 - [전공 공부(생물)/면역학] - Flow cytometry의 기본 원리/면역학 연구실/FACS
'전공 공부(생물) > 면역학' 카테고리의 다른 글
| Flow cytometry 원리/FACS 원리 (10) | 2020.06.24 |
|---|---|
| 사이토카인 폭풍 /"나는 젊으니까 코로나에 안걸릴꺼야"는 거짓말 (9) | 2020.06.23 |
| Innate lymphoid cell group2에 대한 간략한 설명 (0) | 2020.06.22 |
| Ch.9 T-cell-Mediated Immunity / 면역학 정리-1 (0) | 2020.06.21 |
| [Immunology:면역학 용어 정리]/서울대학교 면역학 수업 용어 정리#2 (24) | 2020.06.05 |




댓글